Úvod
1.3. Stavba hmoty
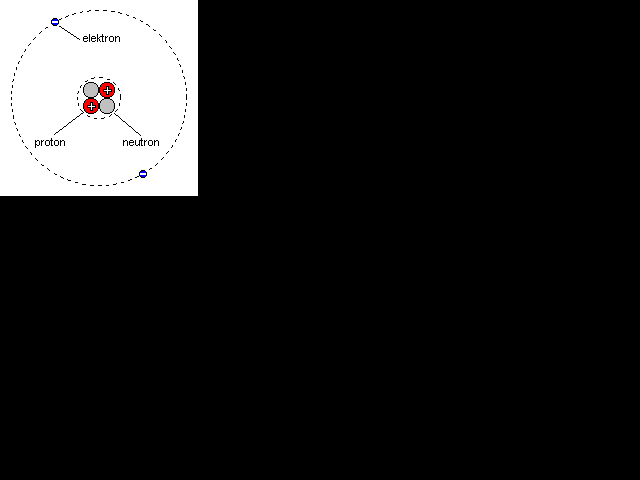 V jádře jsou kladně nabité částice zvané protony, neutrální (bez
el. náboje) částice zvané neutrony a obal tvoří záporně nabité
elektrony, obíhající kolem jádra. Na obrázku je například atom hélia,
sestávající se ze dvou protonů a dvou neutronů v jádře a dvou elektronů
kolem obíhajících. Ve skutečnosti ovšem nelétají po kruhových drahách,
ale velmi složitým způsobem, takže lze jen přibližně určit, jaká je
pravděpodobnost, že se nacházejí tu, či onde. Dlužno ještě dodat, že
elektronů je v atomu vždy stejně jako protonů, ale počet neutronů může
býti různý.
V jádře jsou kladně nabité částice zvané protony, neutrální (bez
el. náboje) částice zvané neutrony a obal tvoří záporně nabité
elektrony, obíhající kolem jádra. Na obrázku je například atom hélia,
sestávající se ze dvou protonů a dvou neutronů v jádře a dvou elektronů
kolem obíhajících. Ve skutečnosti ovšem nelétají po kruhových drahách,
ale velmi složitým způsobem, takže lze jen přibližně určit, jaká je
pravděpodobnost, že se nacházejí tu, či onde. Dlužno ještě dodat, že
elektronů je v atomu vždy stejně jako protonů, ale počet neutronů může
býti různý.Většina atomů může za určitých okolností některé elektrony sdílet s jinými. Takovéto sdílení nastává například uvnitř molekul chemických sloučenin. Atomy některých prvků se svých elektronů "neradi" vzdávají a případné nadbytečné neradi přijímají. Potom hovoříme o tzv. inertních (netečných) prvcích. Mezi ně patří např. Helium, Neon, nebo Argon. Další zase mohou býti velmi reaktivní jako například Chlór, Sodík, Síra či Kyslík. Chemických reakcí se neúčastní všechny elektrony, ale jen tzv. valenční, což jsou elektrony, které se pohybují v poslední vrstvě. Právě na jejich počtu závisí reaktivnost prvků. Atomy vodivých prvků (většinou kovů) mají ještě vodivostní elektrony a ty se zase podílejí na vedení el. proudu. Aby nevznikla nějaká nejasnost, je nutno zde upozornit, že se nejedná o různé druhy elektronů, ale jen o jejich pozice v atomu.
<< Předchozí Obsah Další >>